


0
из 10Решил заданий
0
из 10Не решил заданий
10
из 10Осталось заданий
Формат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие "буква" - "цифра" должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Расчетная задача повышенного уровня сложности
10 заданийСмешали 100 мл 30%-ного раствора хлорной кислоты (ρ = 1,11 г/мл) и 300 мл 20%-ного раствора гидроксида натрия (ρ = 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила 8%?
1) Уравнение реакции:
HClO4 + NaOH = NaClO4 + H2O
2) Рассчитываем количество вещества реагентов:
m = ρ ∙ V; mв-ва = mр-ра ∙ ω; n = mв-ва / Mв-ва
а) mр-ра(HClO4) = 1,11 ∙ 100 = 111 г, m(HClO4) = 111 ∙ 0,3 = 33,3 г, n(HClO4) = 33,3 / 100,5 = 0,331 моль
б) mр-ра(NaOH) = 1,10 ∙ 300 = 330 г, m(NaOH) = 330 ∙ 0,2 = 66 г, n(NaOH) = 66 / 40 = 1,65 моль
3) По уравнению реакции n(HClO4) : n(NaOH) = 1 : 1, следовательно
а) в избытке NaOH в количестве (1,65 – 0,331) = 1,319 моль, mост(NaOH) = 1,319 ∙ 40 = 52,76 г
б) n(NaClO4) : n(HClO4) = 1 : 1, следовательно
n(NaClO4) = n(HClO4) = 0,331 моль
m(NaClO4) = 0,331 ∙ 122,5 = 40,55 г
в) n(H2O) : n(HClO4) = 1 : 1, следовательно
n(H2O) = n(HClO4) = 0,331 моль
m(H2O) = 0,331 ∙ 18 = 5,76 г
4) Рассчитаем количества воды из растворов:
а) из раствора хлорной кислоты
m1(H2O) = mр-ра(HClO4) – m(HClO4) = 111 – 33,3 = 77,7 г
б) из раствора гидроксида натрия
m2(H2O) = mр-ра(NaOH) – m(NaOH) = 330 – 66 = 264 г
5) Вводим обозначения: mдоб(H2O) = x г
ω(NaClO4) = m(NaClO4) / mр-ра(NaClO4),
mр-ра(NaClO4) = m(NaClO4) + mост(NaOH) + m(H2O) + m1(H2O) + m2(H2O) + mдоб(H2O) = 40,55 + 52,76 + 5,96 + 77,7 + 264 + х = 440,97 + х г
$ \displaystyle \frac{40,55}{440,97 + x} = 0,08$
х = 65,9
m(H2O) = 65,9 г
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3·10Н2О. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
1) Уравнения реакций:
2NaOH + H2SO4 = Na2SO4 + 2H2O (1)
Na2CO3·10Н2О + H2SO4 = Na2SO4 + CO2↑ + 11H2O
2) Рассчитываем количество вещества реагентов:
m = ρ ∙ V; mв-ва = mр-ра ∙ ω; n = mв-ва / Mв-ва
а) n(NaOH) = 66 / 40 = 1,65 моль
б) m(H2SO4) = 490 ∙ 0,4 = 196 г, n(H2SO4) = 196 / 98 = 2 моль
в) n(Na2CO3·10Н2О) = 143 / 322 = 0,444 моль
3) По уравнению реакции (2) n(Na2CO3·10Н2О) : n(H2SO4) = 1 : 1, следовательно
а) n(H2SO4) = n(Na2CO3·10Н2О) = 0,444 моль, следовательно, в реакции (1) прореагирует количество H2SO4:
n(H2SO4) = 2 – 0,444 = 1,556 моль
4) По уравнению реакции (1) n(NaOH) : n(H2SO4) = 2 : 1, следовательно
n(NaOH) = 2n(H2SO4) = 2 ∙ 1,556 = 3,112 моль
m(NaOH) = 3,112 ∙ 40 = 124,48 г
ω(NaOH) = m(NaOH) / mр-ра(NaOH)
ω(NaOH) = 124,48 / 1200 = 0,1037, или 10,37%
ω(NaOH) = 0,1
В раствор, содержащий 51 г нитрата серебра, прилили 18,25 г 20%-ного раствора соляной кислоты. Какая масса 26%-ного раствора хлорида натрия потребуется для полного осаждения серебра из получившегося раствора?
AgNO₃ + НCl = AgCl↓ + НNO₃
М(AgNO₃) = 108 + 14 + 48 = 170 (г/моль)
n(AgNO₃) = m/M = 51/170 = 0,3 (моля)
m(HCl) = m*w = 18,25 * 20 /100 = 3,65 (г)
M(HCl) = 1 + 35,5 = 36,5 (г/моль)
n(HCl) = m/M = 3,65 : 36,5 = 0,1 (моля)
Поскольку по уравнению соотношение AgNO₃ и HCl по количеству 1:1, то с 0.1 моля AgNO₃ прореагирует 0,1 моля HCl.
0,3 - 0,1 = 0,2 моль, получается остаток AgNO₃. Для полного осаждения по условию добавляют NaCl:
AgNO₃ + NaCl = AgCl↓ + NaNO₃
На оставшиеся в растворе 0,2 моля ионов серебра в AgNO₃ надо 0,2 моля ионов хлора из NaCl, поскольку из уравнения видно, что вещества реагируют в отношении 1:1.
M(NaCl) = 23 + 35,5 = 58,5 (г/моль)
m(NaCl) = M*n = 58,5 * 0,2 = 11,7 (г)
w = m(в-ва)/m(р-ра)
m(р-ра NaCl) = m(NaCl)/w(NaCl) = 11,7 : 26 * 100 = 45(г)
Рассчитайте, какую массу оксида серы (VI) добавили в 2000 мл 8%-ного раствора серной кислоты (ρ = 1,06 г/мл), если массовая доля серной кислоты стала равной 20%.
1) Уравнение реакции:
SO3 + H2O = H2SO4
2) Рассчитываем массу H2SO4:
m = ρ ∙ V; mв-ва = mр-ра ∙ ω; n = mв-ва / Mв-ва
mр-ра(H2SO4) = 1,06 ∙ 2000 = 2120 г, m(H2SO4) = 2120 ∙ 0,08 = 169,6 г
3) Вводим обозначения:
а) nобр(H2SO4) = х моль – количество вещества H2SO4, образовавшееся в результате реакции
б) по уравнению реакции nобр(H2O) : nобр(H2SO4) = 1 : 1, следовательно
nобр(H2O) = nобр(H2SO4) = х моль, тогда
mобр(H2O) = 18x г
mобр(H2SO4) = 98х г
$\omega(H_2SO_4) = \frac{m(H_2SO_4) + m_{\text{обр}}(H_2SO_4)}{m_{\text{р-ра}}(H_2SO_4) + m_{\text{обр}}(H_2SO_4) - m_{\text{обр}}(H_2O)}$
$\frac{169,9 + 98x}{2120+98x-18x} = 0,2$
х = 3,1
4) По уравнению реакции n(SO3) : n(H2SO4) = 1 : 1, следовательно
n(SO3) = n(H2SO4) = 3,102 моль
m(SO3) = 3,102 ∙ 80 = 248,16 г
m(SO3) = 248,2 г
Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (ρ = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
1) Уравнение реакции:
Mg + H2SO4 = MgSO4 + H2↑
2) Рассчитываем количество вещества реагентов:
m = ρ ∙ V; mв-ва = mр-ра ∙ ω; n = mв-ва / Mв-ва
а) n(Mg) = 4,8 / 24 = 0,2 моль
б) mр-ра(H2SO4) = 1,05 ∙ 200 = 210 г, m(H2SO4) = 210 ∙ 0,12 = 25,2 г, n(H2SO4) = 25,2 / 98 = 0,257 моль
3) По уравнению реакции n(Mg) : n(H2SO4) = 1 : 1, следовательно
а) в избытке H2SO4 в количестве (0,257 – 0,2) = 0,057 моль,
mост(H2SO4) = 0,057 ∙ 98 = 5,586 г
б) n(MgSO4) : n(Mg) = 1 : 1, следовательно
n(MgSO4) = n(Mg) = 0,2 моль
m(MgSO4) = 0,2 ∙ 120 = 24 г
4) Рассчитаем количества воды из раствора серной кислоты:
m(H2O) = mр-ра(H2SO4) – m(H2SO4) = 210 – 25,2 = 184,8 г
5) Рассчитываем массовую долю MgSO4:
ω(MgSO4) = m(MgSO4) / mр-ра(MgSO4),
mр-ра(MgSO4) = m(MgSO4) + mост(H2SO4) + m(H2O) = 24 + 5,586 + 184,8 = 214,386 г,
ω(MgSO4) = 24 / 214,386 ≈ 0,1119, или 11,19%.
ω(MgSO4) = 0,112
Кислород, который образуется при разложении 659,7 г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. Рассчитайте, какая масса аммиака может вступить в реакцию и какой объем (при н.у.) будет иметь азотсодержащий продукт этой реакции.
2KMnO4 = K2MnO4 + MnO2 + O2
4NH3 + 5O2 = 4NO↑ + 6H2O
1)m(примеси)=m (смеси)*w=659,7г*0,042=27,7 г
m чист.( KMnO4)= m р-ра - m(примеси)= 659,7г - 27,7г=632 г
n(KMnO4)= m/M = 632г/158г/моль=4 моль
n(O2)=1/2n*( KMnO4)= 2 моль
2) n(NH3)= 4/5*n(O2) = 1,6 моль
3) m(NH3)= n*M =1,6 моль * 17 г/моль = 27,2 г
4) n(NO) = n(NH3)=1,6 моль
V(NO)=n * Vм= 1,6 моль * 22,4 л/моль=35,84 л
При растворении 2,8 г сплава меди и серебра в концентрированной азотной кислоте образовалось 5,28 г смеси нитратов. Определите массовые доли металлов в сплаве.
1) Уравнения реакций:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O (1)
Ag + 2HNO3 = AgNO3 + NO2↑ + H2O (2)
2) Вводим обозначения: n(Cu) = x моль, n(Ag) = y моль; тогда
а) m(Cu) = 64x г, m(Ag) = 108y г, mсмеси = 64x + 108y = 2,8 г;
б) по уравнению (1)
n(Cu(NO3)2) = x моль, m(Cu(NO3)2) = 188x г;
в) по уравнению (2)
n(AgNO3) = y моль, m(AgNO3) = 170y г;
г) mсмеси = 188x + 170y = 5,28 г.
3) Составляем и решаем систему уравнений:
$\begin{cases} 64x+108y =2,8 \\ 188x + 170y =5,28 \end{cases} \qquad \begin{cases} x = 0,01 \text{ моль } Cu \\ y = 0,02 \text{ моль } Ag \end{cases}$
4) Рассчитываем массовые доли компонентов смеси:
а) m(Cu) = 0,01 ∙ 64 = 0,064 г; ω(Cu) = 0,64/2,8 ≈ 0,2286, или 22,86%;
б) m(Ag) = 0,02 ∙ 108 = 2,16 г; ω(Ag) = 2,16/2,8 ≈ 0,7714, или 77,14%.
ω(Cu) ≈ 0,2286, или 22,86%
ω(Ag) ≈ 0,7714, или 77,14%
На 21,6 г серебра подействовали 68%-ным раствором азотной кислоты, масса которого 600 г. Полученный при этом газ пропустили через 300 г 10%-ного холодного раствора гидроксида натрия. Рассчитайте массовые доли веществ в полученном растворе.
Уравнения реакций:
Ag + 2HNO3 = AgNO3 + NO2↑ + H2O (1)
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O (2)
1) n(Ag)=21.6/108=0,2 моль
m(HNO3)=600*0.68=408 г
n(HNO3)=408/63 = 6.5 моль
Азотная кислота в избытке, расчёт ведём по серебру
2) n(NO2)= 0.2 моль
m(NaOH)=300*0.1=30г
n(NaOH)=30/40=0.75 моль
NaOH в избытке, расчёт по NO2
3) n (NaNO2)=0.1 моль
m (NaNO2)=0.1*69=6.9 г
n (NaNO3)=0.1 моль
m (NaNO3)=0.1*85=8.5 г
осталось NaOH: 0.75-0.2=0.55 моль
mост (NaOH) = 0,55*40 = 22г
m (конечного раствора) = m (р-ра NaOH) + m(NO2)= 300+ 0.2*46=309.2 г
ω (NaOH) = 100*22/309.2= 7,1%
ω (NaNO2) = 100*6.9/309.2= 2,2%
ω (NaNO3) = 100*8.5/309.2= 2,7%
ω (H2O) = 100 – 7.1 – 2.2 – 2.7 = 88%
Оксид, образовавшийся при сжигании 18,6 г фосфора в 44,8 л (н.у.) кислорода, растворили в 100 мл дистиллированной воды. Рассчитайте массовую долю ортофосфорной кислоты в полученном растворе.
1) Уравнения реакций:
4P + 5O2 = 2P2O5 (1)
P2O5 + 3H2O = 2H3PO4 (2)
1) Количества и массы реагирующих веществ:
m = ρ ∙ V; n = mв-ва / Mв-ва; n = Vг / VM
а) количество воды
m(H2O) = 1 ∙ 100 = 100 г,
n(H2O) = 100 / 18 = 5,56 моль,
б) количество фосфора
n(P) = 18,6 / 31 = 0,6 моль,
в) количество кислорода
n(O2) = 44,8 / 22,4 = 2 моль.
2) По уравнению (1)
n(P) : n(O2) : n(P2O5) = 4 : 5 : 2, следовательно,
а) в избытке O2 в количестве (2 – 0,6 ∙ 5/4) = 1,25 моль,
б) n(P2O5) = 0,5n(P) = 0,6 / 2 = 0,3 моль P2O5, m(P2O5) = 0,3 ∙ 142 = 42,6 г.
3) По уравнению (2)
n(P2O5) : n(H3PO4) = 1 : 2, H2O – в избытке,
n(H3PO4) = 2n(P2O5) = 2 ∙ 0,3 = 0,6 моль,
m(H3PO4) = 0,6 ∙ 98 = 58,8 г.
4) Рассчитываем массовую долю H3PO4:
ω(H3PO4) = m(H3PO4) / mр-ра(H3PO4),
mр-ра(H3PO4) = m(P2O5) + m(H2O) = 42,6 + 100 = 142,6 г,
ω(H3PO4) = 58,8 / 142,6 ≈ 0,4123, или 41,23%.
ω(H3PO4) ≈ 0,4123, или 41,23%
Смесь оксида меди(I) и оксида меди(II) общей массой 50,0 г растворили в концентрированной серной кислоте. При этом выделился газ, который может обесцветить 1000 г 4,0-процентной бромной воды. Рассчитайте массовые доли (в %) веществ в исходной смеси. Относительную атомную массу меди примите равной 64.
|
Содержание ответа |
Баллы |
|
Вариант ответа: 1. Записываем уравнения реакций Cu2O + H2SO4 = 2CuO + SO2 + H2O CuO + H2SO4 = CuSO4 + H2O SO2 + Br2 + 2H2O = 2HBr + H2SO4 2. Рассчитываем массу брома m(Br2) = (m раствора * W)/ 100% m(Br2) = 1000 г * 4% / 100% = 40 г 3. найдем количество вещества брома n(Br2) = 40 г / 160 г/моль = 0,25 моль 4. по уравнению у нас на 1 моль SO2 расходуется 1 моль Br2
значит n(SO2) = 0,25 моль рассмотрим первое уравнение из 1 моль Cu2O образуется 1 моль SO2 значит n (Cu2O) тоже равно 0,25 моль найдем его массу m= n*M m(Cu2O) = 0,25 моль * 144 г/моль =36 г 5. найдем массовую долю Cu2O в смеси w =(m Cu2O/ m смеси ) * 100% W(Cu2O) = (36 г/ 50 г ) *100% = 72% тогда W CuO будет 100% - 72% = 28 % |
|
|
Ответ правильный и полный, содержит следующие элементы:
|
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записаны один элемент ответа |
1 |
|
Все элементы ответа записаны неверно. |
0 |
|
Максимальный балл |
4 |

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

Решено верно

«Выбери тест, предмет и нажми кнопку «Начать решать»
После выбора предмета необходимо выбрать на вкладке задания, варианты ЕГЭ, ОГЭ или другого теста, или теорию
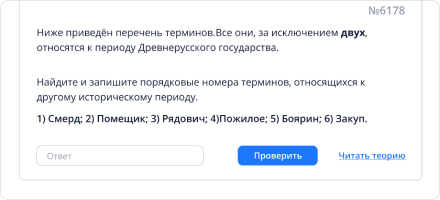
Решай задания и записывай ответы. После 1-ой попытки ты сможешь посмотреть решение
Сбоку ты можешь посмотреть статистику и прогресс по предмету
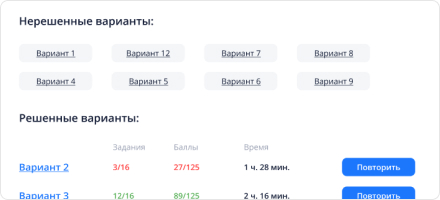
Нажми, чтобы начать решать вариант. Как только ты перейдешь на страницу, запустится счетчик времени, поэтому подготовь заранее все, что может тебе понадобиться

Отмечай те статьи, что прочитал, чтобы было удобнее ориентироваться в оглавлении

Ты прошел обучение! Теперь ты знаешь как пользоваться сайтом и можешь переходить к решению заданий