48. Квантовая и ядерная физика
 Читать 0 мин.
Читать 0 мин.
48.28. Квантовая механика
Опыт Резерфорда. В 1911 г. Эрнест Резерфорд проводил опыты, бомбардируя потоком α–частиц (α–частица представляет собой тяжелую положительно заряженную частицу) тонкие пластинки фольги. В ходе опытов выяснилось, что большинство α–частиц проходят фольгу насквозь, немного отклоняясь, но некоторые рассеиваются с большим углом отклонения.
Так как α–частицы обладают положительным зарядом, рассеивать их могло лишь электростатическое поле. α – частицы также достаточно массивны, поэтому не могли отклоняться электронами, которые легче на несколько порядков. Следовательно, α – частицы рассеивались электростатическим полем массивного объекта ― ядра атома.
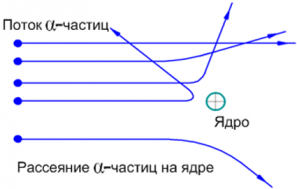
Проанализировав результаты опытов, Резерфорд разработал «планетарную модель атома», согласно в центре атома располагается массивное положительно заряженное ядро, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов. Ядро окружено легкими, движущимися по орбитам вокруг ядра, отрицательно заряженными электронами.
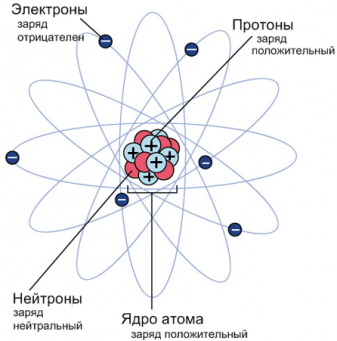
Ядро обозначается в виде ${}_Z^AX$ , где
X ― название химического элемента;
Z ― зарядовое число, равное количеству протонов в ядре;
A ― массовое число, равное количеству протонов и нейтронов в ядре.
Поскольку массовое число атомов равно сумме протонов и нейтронов, то можно найти число нейтронов в атоме: n = A – Z. Число электронов в атоме равно число протонов.
Изотопы ― это атомы, или ядра одного элемента, но с разной массой, например ${}_{92}^{235}U$ и ${}_{92}^{238}U$ . У изотопов одинаковое число протонов в ядре, но разное число нейтронов. Например ядро ${}_{92}^{235}U$ имеет 92 протона и 143 нейтрона, а ядро ${}_{92}^{238}U$ ― 146 нейтронов.
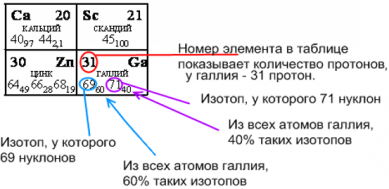
Пример анализа состава атома по таблице химических элементов Менделеева. Состав ядра самого распространенного изотопа галлия ${}_{69}^{31}Ga$ : 31 протон, 69 нуклонов (протонов и нейтронов вместе), 38 нейтронов. Этот изотоп встречается в 60% случаев. У атома галлия 31 электрон.
Радиоактивный распад ― спонтанное изменение состава ядра атома. Радиоактивность ― это процесс радиоактивного распада. При радиоактивном распаде ядро атома испускает альфа–частицы, электроны или гамма излучение.
Закон радиоактивного распада описывает статистическую закономерность ― он позволяет определить, сколько атомных ядер распалось в начальном образце. При этом узнать, какое именно из ядер распадется в следующий раз невозможно. Распад ядра – очень быстрый процесс, о времени распада каждого отдельного ядра также ничего нельзя сказать.
Закон радиоактивного распада имеет вид N(t) = N0 ∙ 2–t/T, где
N(t) ― число атомов в момент времени t;
N(0) ― число атомов радиоактивного элемента в начальный момент;
T ― период полураспада;
t ― время, которое прошло с начального момента.
Период полураспада показывает, за какое время половина всех атомов в образце распадется.
Закон радиоактивного распада может быть также записан с использованием не числа атомов элемента, а концентрации атомов в образце, или массы атомов в образце.
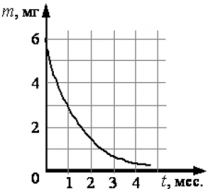
Пример: если в образце находится m0 (кг) радиоактивного элемента, то через время, равное периоду полураспада t = T, в образце останется m(T) (кг): m(T) = $\frac{m_0}{2^{T/T}} = \frac{m_0}{2}$ (кг). Спустя еще один период полураспада t = 2T, в образце останется m(2T) (кг): m(2T) = $\frac{m_0}{2^{2T/T}} = \frac{m_0}{2^2} = \frac{m_0}{4}$ (кг).
Спустя три периода полураспада t = 3T ― m(3T) = $\frac{m_0}{2^{3T/T}} = \frac{m_0}{2^3} = \frac{m_0}{8}$ (кг).
Спустя четыре периода полураспада t = 4T ― m(4T) = $\frac{m_0}{2^{4T/T}} = \frac{m_0}{2^4} = \frac{m_0}{16}$ (кг) и т. д.
График изменения массы радиоактивного элемента, находящегося в образце имеет экспоненциальный вид:
Наиболее распространенные типы радиоактивного распада ― α–распад, электронный β–распад, γ–распад. Эти распады происходят по следующим схемам:
α–распад: ${}_Z^A X \underset{\alpha - \text{распад}}{\longmapsto} {}_{Z-2}^{A-4}Y + \underset{\alpha - \text{частица}}{\underbrace{{}_2^4He}}$
При α–распаде заряд ядра атома уменьшается на 2, а массовое число уменьшается на 4, и излучается α–частица ― ядро гелия.
β–распад: ${}_Z^A X \underset{\beta - \text{распад}}{\longmapsto} {}_{Z+1}^{A}Y + {}_{-1}^0e$
При электронном β–распаде один из нейтронов в ядре превращается в протон, ядро испускает один электрон ${}_{-1}^0e$ . Из–за превращения нейтрона в протон, зарядовое число увеличивается на 1, а масса не изменяется.
γ–распад ― это испускание ядром гамма–излучения (электромагнитной волны высокой частоты)
${}_Z^A X \underset{\gamma - \text{распад}}{\longmapsto} {}_{Z}^{A}X + \gamma$
При γ–распаде заряд и масса ядра не изменяются.
Законы сохранения. При протекании ядерной реакции сохраняется суммарное массовое число и суммарный заряд элементов:
${}_{Z1}^{A1}X + {}_{Z2}^{A2}Y = {}_{Z3}^{A3}Z + {}_{Z4}^{A4}\Omega$
Сумма масс элементов слева, до ядерной реакции, равна сумме масс справа, после ядерной реакции: А1 + А2 = А3 + А4.
Сумма зарядов элементов слева, до ядерной реакции, равна сумме зарядов справа, после ядерной реакции: Z1 + Z2 = Z3 + Z4.