23. Молекулярная физика
 Читать 0 мин.
Читать 0 мин.
23.121. Газовые процессы
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
pV = $\frac{m}{M}R \cdot T$ , где
p — давление [Па],
V — объём [м3],
R — универсальная газовая постоянная 8,31 [Дж/моль∙К],
T — абсолютная температура [K].
Количество вещества — физическая величина, характеризующая количество атомов или молекул, содержащихся веществе. Единица измерения количества вещества —моль.
υ = $\frac{m}{M}$ , где
υ ― количество вещества [моль],
m — масса [кг],
M — молярная масса [кг/моль].
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
Изохорический процесс — термодинамический процесс, который происходит при постоянном объёме. Следовательно, объем V не изменяется, и значение давления прямолинейно зависит от температуры.
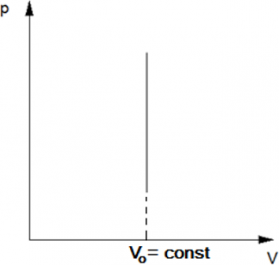
Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма, например, в запаянном сосуде.
Изобарический процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа. Следовательно, давление р не изменяется, и значение объёма прямолинейно зависит от температуры.
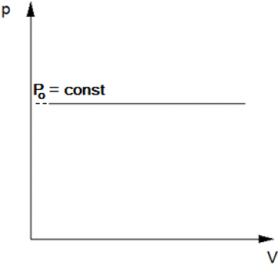
Простейшим примером изобарического процесса может служить нагревание воды в открытом сосуде.
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре. Следовательно, температура Т не меняется, и значение давления обратно пропорционально объему(гипербола).
p = $\frac{vRT}{V}$ = $\frac{const}{V}$ .
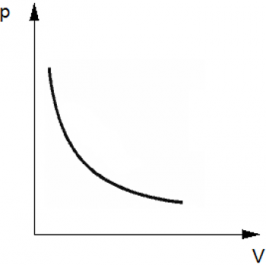
График имеет вид гиперболы, поскольку давление обратно пропорционально объему при постоянной температуре.
Рассмотрим две изотермы с одинаковой массой, но разной температурой на pV диаграмме (T1 < T2).
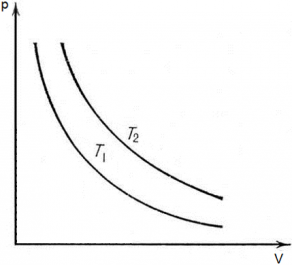
Изотерма с температурой Т2 будет располагаться на диаграмме pV выше, чем изотерма с температурой Т1, как следствие закона pV = vRT. Так как при большем значение температуры значение коэффициента перед V в уравнении p = $\frac{vRT}{V}$ будет больше (vRT2 ˃ vRT1), следовательно, гипербола будет выше.
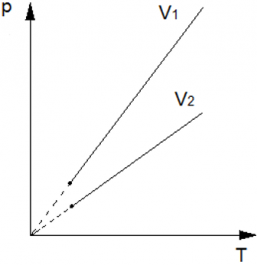
Теперь рассмотрим две изохоры одной массы, но разного объёма (V2 > V1) на pT диаграмме. Изохора с V1 будет выше V2, аналогично, как следствие закона pV = vRT. Так как при большем значении объема, коэффициент при Т будет меньше $\big( \frac{vR}{V_2} < \frac{vR}{V_1} \big)$ , а следовательно и прямая на диаграмме pT, будет ниже.