6. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
6.82. Изменения свойств в таблице Менделеева
Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства.
Атомы элементов одного периода имеют одинаковое число энергетических уровней.
Периодический закон: «свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома».
Закономерности изменения свойств элементов по группам и периодам:
Увеличивается: заряд, ЭО, окислительные свойства, неметаллические свойства
Уменьшается: радиус, восстановительные свойства, металлические свойства
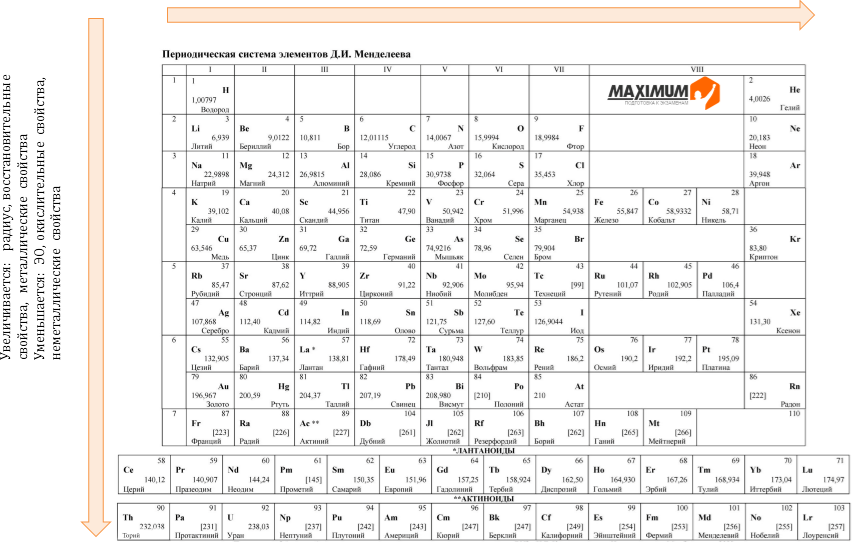
Изменение некоторых характеристик элементов в периодах слева направо:
-
заряд ядер атомов увеличивается;
-
радиус атомов уменьшается, потому-что происходит сжатие. Ядру требуется больше энергии, чтобы удержать большое количество электронов, на внешнем уровне;
-
электроотрицательность элементов увеличивается. (Самый электроотрицательный эелемент – F);
-
количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
-
высшая степень окисления увеличивается (равна номеру группы);
-
число электронных слоев атомов постоянно, так как это число равно номеру периода;
-
металлические свойства уменьшаются, так как к концу периода распалагаются неметаллы;
-
неметаллические элементов увеличивается. (Неметалличность – это способность атомов элемента присоединять электроны).
Изменение некоторых характеристик элементов в группе сверху вниз:
-
заряд ядер атомов увеличивается;
-
радиус атомов увеличивается, потому что увеличивается число электронных слоев;
-
число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода);
-
число электронов на внешнем слое атомов одинаково (равно номеру группы);
-
прочность связи электронов внешнего слоя с ядром уменьшается;
-
электроотрицательность уменьшается;
-
металличность элементов увеличивается, так как самый типичный металл — это Fr. (Металличность – это способность элемента отдавать электроны);
-
неметалличность элементов уменьшается.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т. к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
Электроотрицательностью элемента характеризуется способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.