

6. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
6.584. Электролиз
Электролиз ― это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
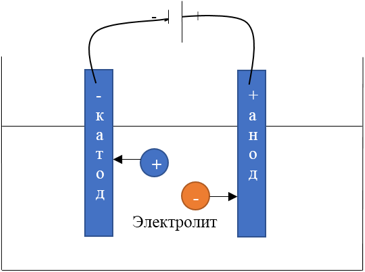
Катод К(-), к нему перемещаются катионы, катод отдаёт электроны катионам, катионы разряжаются, идёт процесс восстановления.
Анод А(+), к нему перемещаются анионы, анионы отдают электроны аноду и разряжаются, идёт процесс окисления.
Схема движения ионов в растворе или расплаве электролита под действием электрического тока:
Электролиз растворов отличается от электролиза расплавов тем, что процессы протекают сложнее из-за непосредственного участия воды.
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
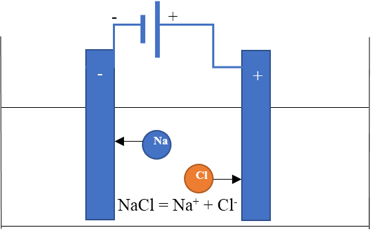
Схема электролиза расплава хлорида натрия:
- на катоде всегда идет процесс восстановления;
- на аноде всегда идет процесс окисдления.
При электролизе растворов как на аноде, так и на катоде могут происходить конкурирующие процессы.
Конкурирующими являются два окислительных и восстановительных процесса:
-
на аноде — окисление анионов и гидроксид-ионов;
-
на катоде — восстановление катионов и ионов водорода.
Катодные процессы в водных растворах солей:
Электрохимическийряд напряжений металлов
|
Li, K, Ca, Na, Mg, Al |
Mn, Zn, Fe, Ni, Sn, Pb |
H2 |
Cu, Hg, Ag, Pt, Au |
|
Men+ — не восстанавливаются 2H2O + 2e = H2 + 2OH- |
Men+ + ne = Me0 2H2O +2e = H2 + 2OH- |
H2 |
Men+ + ne = Me0 |
Процесс на аноде зависит от материала анода и от природы аниона:
- Если анод растворимый (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода.
- Если анод нерастворимый (уголь, графит, платина, золото), то:
- При электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона.
- При электролизе растворов солей оксокислот и фторидов на аноде идет процесс окисления воды (выделяется кислород); анион не окисляется, остается в растворе. При электролизе растворов щелочей идет окисление гидроксид-ионов.
Электролиз широко используется в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом.
Важной отраслью применения электролиза является защита металлов от коррозии; при этом электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла — устойчивость к коррозии.






















