6. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
6.450. Окислительно-восстановительные реакции – базовый уровень сложности
Сегодня речь пойдет об окислительно-восстановительных реакциях.
Окислительно-восстановительные реакции (ОВР) - это химические реакции про протекании которые степени окисления элементов изменяются
Любая окислительно-восстановительная реакция представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением — степень окисления повышается.
Процесс присоединения электронов называется восстановлением — степень окисления понижается.
Частицы, которые отдают электроны, называются восстановителями — степень окисления повышается.
Частицы, которые принимают электроны, называются окислителями — степень окисления понижается.
В общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
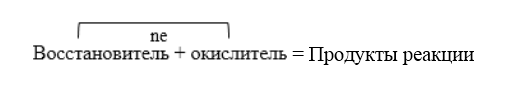
Важнейшими окислителями являются:
- Простые вещества — неметаллы с наибольшими значениями электроотрицательности — фтор, кислород.
- Сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия (KMnO4), дихромат калия (K2Cr2O7), азотная кислота (HNO3), концентрированная серная кислота (H2SO4), оксид свинца (PbO2), хлорная кислота (HClO4).
Важнейшими восстановителями являются:
- Все простые вещества — металлы.
- Сложные вещества, молекулы которых содержат элементы в низшей степени окисления — метан, силан (SiH4), аммиак (NH3), фосфин (PH3), нитриды и фосфиды металлов, сероводород (H2S) и сульфиды металлов, галогеноводороды и галогениды металлов, гидриды металлов.
Типы окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции.
В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ.
N20 + H20 = N-3H3+1
N – окислитель
H – восстановитель
2. Внутримолекулярные окислительно-восстановительные реакции.
В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества.
(N-3H4)2Cr2+6O7 = N20 + Cr2+3O3 + SO42- + Ba2+ = BaSO4 ↓
N – восстановитель
Cr – окислитель
3. Реакции самоокисления-самовосстановления — реакции диспропорционирования.
Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется, и восстанавливается.
N+4O2 + H2O = HN+5O3 + HN+3O2
N –окислитель и восстановитель.
Метод электронного баланса
Общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
1. Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
K+1Mn+7O4-2 + K+1Br-1 + H2+1S+6O4-2 = Mn+2S+6O4-2 + Br20 + K2+1S+6O4-2 + H2+1O-2
2. Выделяем символы элементов, которые изменили степень окисления:
K+1Mn+7O4-2 + K+1Br-1 + H2+1S+6O4-2 = Mn+2S+6O4-2 + Br20 + K2+1S+6O4-2 + H2+1O-2
Составляем уравнения процессов окисления и восстановления:
Mn+7 + 5e = Mn+2 (восстановление)
2Br-1 – 2e = Br20 (окисление)
3. Находим наименьшее общее кратное (в данной реакции это 10)
$\begin{array}{l|r|l} {\color{red} {Mn^{+7} +5e = Mn^{+2}} }& {} & 2 - \text{окислитель}\\ {}&10 & {}\\ {\color{blue} {2Br^{-1} - 2e = Br_2^0}} & {}& 5 - \text{восстановитель} \end{array} $
Роль окислительно-восстановительных реакций в природе и практической деятельности человека
Большинство химических реакций, протекающих в природе и осуществляемых человеком в его практической деятельности, представляют собой окислительно-восстановительные реакции:
- процесс фотосинтеза;
- горение природного газа;
- получение металлов из руд;
- синтез аммиака.