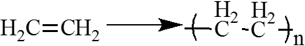
41. Органическая химия
 Читать 0 мин.
Читать 0 мин.
41.170. Углеводороды – алканы, алкены, циклоалканы
Алканы и циклоалканы
Алканы (предельные или насыщенные углеводороды, парафины) — углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2. Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
|
Алканы |
Ряд метана |
|
Формула |
Название |
|
СН4 |
Метан |
|
С2Н6 |
Этан |
|
С3Н8 |
Пропан |
|
С4Н10 |
Бутан |
|
С5Н12 |
Пентан |
|
С6Н14 |
Гексан |
|
С7Н16 |
Гептан |
|
С8Н18 |
Октан |
|
С9Н20 |
Нонан |
|
С10Н22 |
Декан |
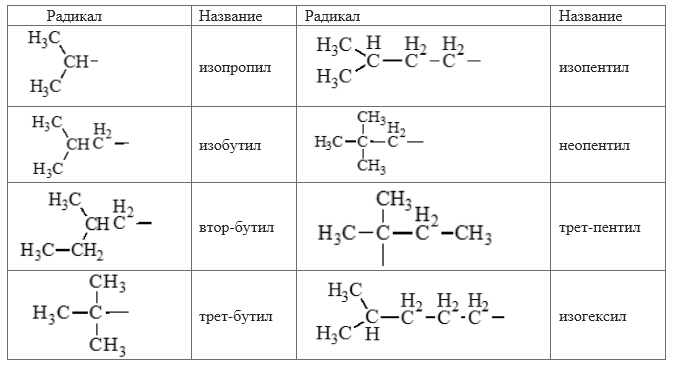
Таблица изомеров и название радикалов
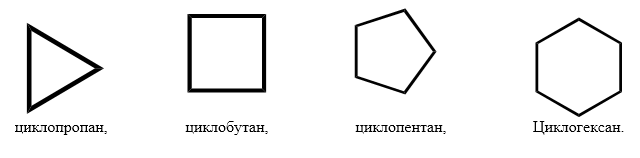
При замыкании углеводородной цепи в цикл с потерей двух атомов водорода образуются моноциклоалканы с общей формулой CnH2n. Циклизация начинается с C3, названия образуются от Cn с префиксом цикло–:
Изомерия алканов и циклоалканов:
1. Углеродного скелета
Пространственные изомеры могут быть у циклоалканов:
Конформеры находятся в динамическом равновесии и превращаются друг в друга через нестабильные формы. Неустойчивость плоских циклов вызвана значительной деформацией валентных углов. При сохранении тетраэдрических валентных углов для циклогексана C6H12 возможны две устойчивые конформации: в форме кресла и в форме ванны:
Химические cвойства алканов:
1. Галогенирование:
СH4+Cl2=CH3Cl+HCl
2. Нитрование:
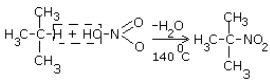
3. Реакции горения:
С5H12+8O2=5CO2+6H2O
4. Сульфохлорирование:
CH3(CH2)10CH3+SO2+Cl2→CH3(CH2)10CH2- SO2Cl+HCl
CH3(CH2)10CH2- SO2Cl+2NaOH→CH3(CH2)10- CH2SO3Na+NaCl
Это свойство используется при получении синтетических моющих средств.
Химические свойства циклоалканов:
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
1. Малые циклы (С3 — С4) довольно легко вступают в реакции гидрирования:
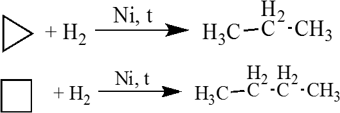
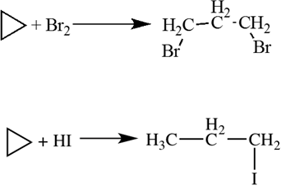
Циклопропан и его производные присоединяют галогены и галогеноводороды:
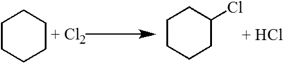
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
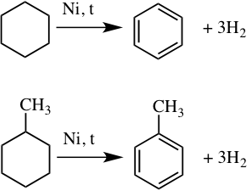
2. Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
3. Окисление циклоалканов (циклогексан).
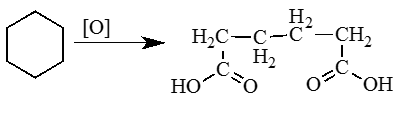
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
Алкены
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
|
Алкены |
Ряд этилена |
|
Формула |
Название |
|
С2Н4 |
Этен |
|
С3Н6 |
Пропен |
|
С4Н8 |
Бутен |
|
С5Н10 |
Пентен |
|
С6Н12 |
Гексен |
|
С7Н14 |
Гептен |
|
С8Н16 |
Октен |
|
С9Н18 |
Нонен |
|
С10Н20 |
Декен |
Виды изомерии:
Помимо изомерии, связанной со строением углеродной цепи, в ряду олефинов наблюдается изомерия положения двойной связи. Кроме того, у олефинов имеет место пространственная (геометрическая) или цис-транс-изомерия.
Для изучения материала по названному виду изомерии необходимо просмотреть анимационный фильм “Цис-транс-изомерия в ряду алкенов”. Обращаем внимание на то, что текст, сопровождающий этот фильм. в полном объеме перенесен в данный подраздел и ниже следует.
Цис-транс-изомерия в ряду алкенов
Наряду с изомерией, связанной со строением углеродного скелета и положением двойной связи, в ряду алкенов имеет место геометрическая или цис-транс-изомерия. Ее существование обусловлено отсутствием свободного вращения атомов, связанных двойной связью.
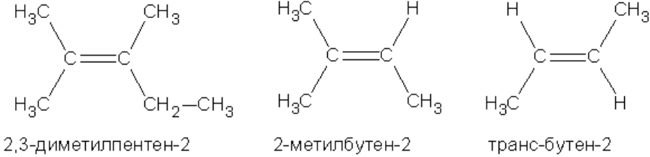
Метильные группы в приведенных примерах могут располагаться как по одну сторону двойной связи (такой изомер называется цис-изомером), так и по разные стороны (такой изомер называется транс-изомером). Названия упомянутых изомеров происходят от латинского cis - на этой стороне и trans- через, на другой стороне. Превращение изомеров друг в друга невозможно без разрыва двойной связи”.
Химические свойства алкенов:
1. Присоединение галогенов.
CH2=CH-CH3+Cl2→CH2Cl-CHCl-CH3
2. Присоединение водорода.
CH2 = CH-CH3+Н2→CH3-CH2-CH3
3. Присоединение галогенводородов.
CH2 = CH-CH3+НCl→CH3-CHCl-CH3
Присоединение протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Присоединение воды.
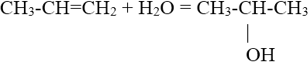
5. Окисление перманганатом калия в нейтральной или слабощелочной среде (реакция Вагнера).
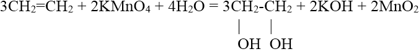
6. Полимеризация алкенов.