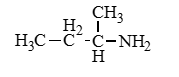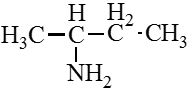41. Органическая химия
 Читать 0 мин.
Читать 0 мин.
41.418. Амины и аминокислоты
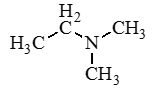
Амины — это производные аммиака (NH3), в молекуле которого один, два или три атома водорода замещены углеводородными радикалами.
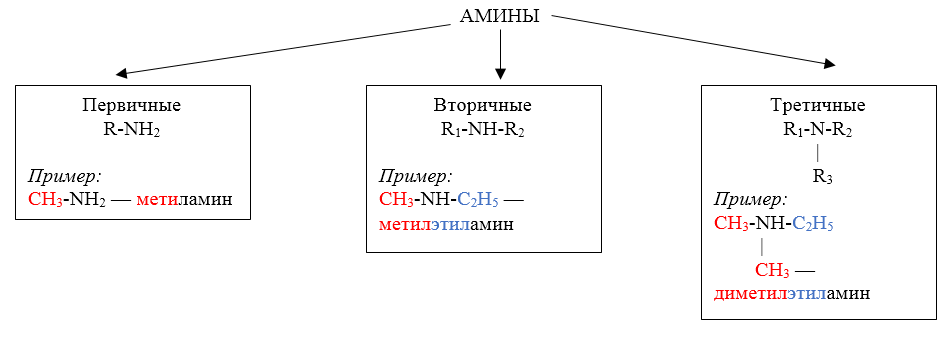
Классификация аминов
Номенклатура первичных аминов
|
Радикально-функциональная |
Заместительная |
|
|
CH3-NH2 |
Метиламин |
Аминометан |
|
|
Изопропиламин |
2-аминопропан |
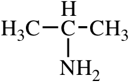
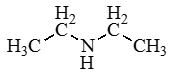
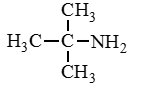
Изомерия
Рассмотрим все виды изомерии на примере C4H11N
|
Изомерия цепи |
Изомерия положения функциональной группы |
Изомерия между типами аминов |
|
|
CH3-CH2-CH2-CH2-NH2 |
|
|
|
|
|
Физические свойства:
Низшие предельные первичные амины — газообразные вещества, имеют запах аммиака, хорошо растворяются в воды. Амины с большей относительной молекулярной массой — жидкости или твердые вещества, растворимость из в воде с увеличением молекулярной массы уменьшается.
Химические свойства аминов
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
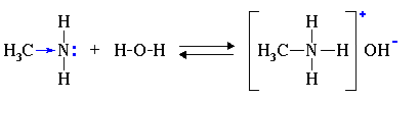
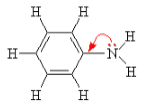
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины — более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:

При нагревании щелочи вытесняют из них амины:
[CH3NH3]+Cl- + NaOH = CH3NH2 + NaCl + H2O
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2
Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 — неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl = НNO2 + KCl
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
-
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 = R-OH + N2 + H2O
-
Вторичные амины (алифатические и ароматические) под действием HNO2
превращаются в нитрозосоединения (вещества с характерным запахом).
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Анилин – простейший представитель первичных ароматических аминов.

Физические свойства:
Бесцветная масляниста жидкость с характерным запахом, малорастворим в воде, ядовит.
Применение анилина:
1. Взрывчатые вещества.
2. Пластмассы.
3. Фотореактивы.
4. Красители.
5. Лекарственные вещества.
Аминокислоты
Аминокислоты — это производные углеводородов, содержащие аминогруппы (-NH2) и карбоксильные группы (-COOH).
Общая формула: (NH2)mR(COOH)n, где m и n чаще всего равны 1 или 2.
Классификация аминокислот:
По числу функциональных групп:
1. моноаминомонокарбоновые кислоты;
2. диаминомонокарбоновые кислоты;
3. моноаминодикарбоновые кислоты.
По положению аминогрупп:
1. α — аминокислоты;
2. β — аминокислоты;
3. γ — аминокислоты.
Формулы и названия некоторых α — аминокислот, остатки которых входят в состав белков.
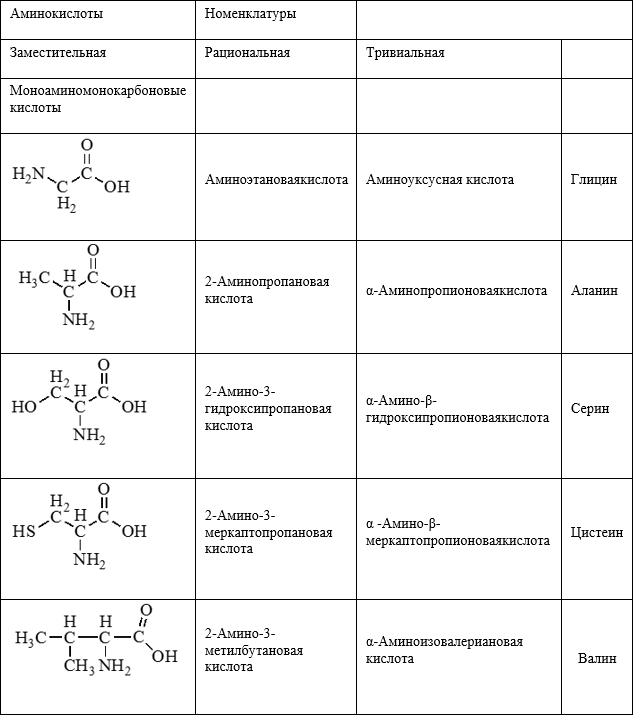
Аминокислоты организма:
1. Заменимые (Синтезируются в организме человек. К ним относятся глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота, тирозин, цистеин).
2. Незаменимые (Не синтезируются в организме человека, поступают с пищей. К ним относятся валин, лизин, фенилаланин).
Физические свойства аминокислот:
Аминокислоты — бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230-300. Многие α-аминокислоты имеют сладкий вкус.
Химические свойства аминокислот:
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:

Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
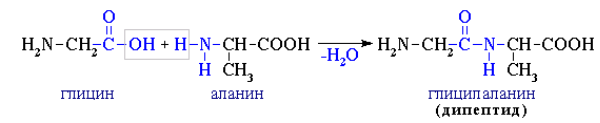
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa -натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации):
NH2-CH2-COOH + CH3OH → NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 — метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]+Cl-
или HOOC - CH2 - NH2* HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота