41. Органическая химия
 Читать 0 мин.
Читать 0 мин.
41.263. Углеводороды – алкины, алкадиены, ароматические соединения (арены)
АЛКИНЫ:
|
Алкины |
Ряд ацетилена |
|
Формула |
Название |
|
С2Н2 |
Этин |
|
С3Н4 |
Пропин |
|
С4Н6 |
Бутин |
|
С5Н8 |
Пентин |
|
С6Н10 |
Гексин |
|
С7Н12 |
Гептин |
|
С8Н14 |
Октин |
|
С9Н16 |
Нонин |
|
С10Н18 |
Децин |
|
Общая формула СnН2n-2 |
Изомерия алкинов:
1. Для алкинов, так же как и для алкенов, характерна структурная изомерия:
-
изомерия углеродного скелета
-
изомерия положения кратной связи
2. Для алкинов характерна межклассовая изомерия с некоторыми другими классами углеводородов, отвечающими той же общей формуле, например с диенами и циклоалкенами.
3. Геометрическая (цис/транс-) изомерия в случае алкинов невозможна, так как молекулы с тройной связью имеют линейное строение углеродной цепи.
Физические свойства:
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства:
1. Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
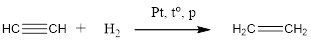
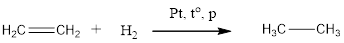
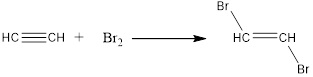
2. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.
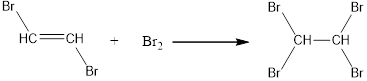
3. Гидрогалогенирование.

4. Гидратация (реакция Кучерова)
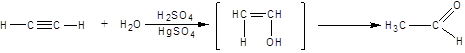
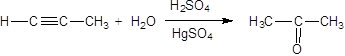
5. Кислотные свойства алкинов
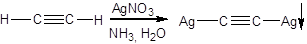
6. Окисление алкинов
5HCCR + 8KMnO4 + 24HCl = 5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2С2Н2 + 5О2 = 4СО2 + 2Н2О.
АЛКАДИЕНЫ:
Из названия класса видно, что молекула должна содержать две двойные связи. Из названия класса видно, что молекула должна содержать две двойные связи. Следовательно, общая формула гомологического ряда диеновых углеводородов CnH2n-2.
По взаимному расположению двойных связей и химическим свойствам диены делятся на три группы:
1. Диены с соседним расположением двойных связей называют диенами умулированными связями. Эти соединения малоустойчивы и легко перегруппировыватся в алкины.
2. Диены, у которых двойные связи разделены более чем одной простой связью, называются диенами с изолированными связями. Их реакции ничем не отличаются от реакций с той лишь разницей, что в реакции может вступить одна или две связи.
3.Диены с 1,3-полрожением двойных связей (двойные связи разделены одной простой) несколько отличаются по свойствам от алкенов и важны с практической точки зрения. Это послужило причиной обособления их в отдельную группу. такие диены называют иенами с сопряжёнными связями. Обычно, когда речь идёт просто о диенах, подразумевается 1,3-диены.
Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета.
2) изомерия положения двойных связей
3) цис-транс-изомерия.
8.2.Химические свойства алкадиенов
1. Для алкадиенов характерны реакции присоединения. (+галогены, водород, галогеноводород и т.д.)
CH2=CH-CH=CH2+Br2
 CH2Br-CH=CH-CH2Br
CH2Br-CH=CH-CH2Br
2.Реакции полимеризации:
n(CH2=CH-CH=CH2)
 ( -CH2-CH=CH-CH2-)n
( -CH2-CH=CH-CH2-)n
АРЕНЫ:
|
Название |
Формула |
|
Бензол |
C6H6 |
|
Толуол |
C6H5CH3 |
|
Этилбензол |
C6H5C2H5 |
|
Изопропилбензол (кумол) |
C6H5CH(CH3)2 |
|
Стирол |
C6H5CH=CH2 |
Изомерия Аренов:
Диметилбензолы изомерны друг другу. Изомерные триметилбензолы:
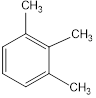 1,2,3-триметилбензол
1,2,3-триметилбензол
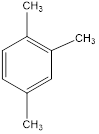 1,2,4-триметилбензол
1,2,4-триметилбензол
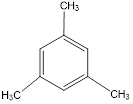 1,3,5-триметилбензол
1,3,5-триметилбензол
Им изомерны также метилэтилбензолы (приведем в пример один из них), а также пропил- и изопропилбензолы:
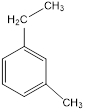 м-метилэтилбензол
м-метилэтилбензол
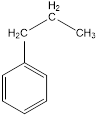 пропилбезол
пропилбезол
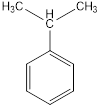 изопропилбензол
изопропилбензол
У аренов есть и межклассовые изомеры – соединения с несколькими двойными и тройными связями, циклы и т.п.
Химические свойства аренов:
I. РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C6H6 + 15O2 t → 12CO2 + 6H2O.
Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4+28H2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14H2O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C6H5-CH3 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
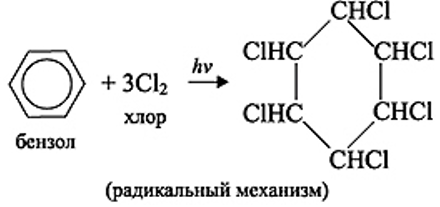
2. Гидрирование
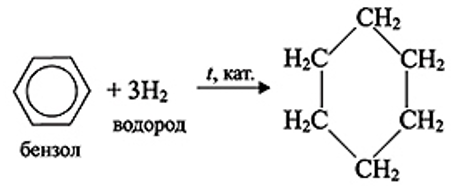
3. Полимеризация
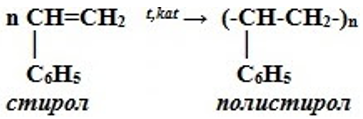
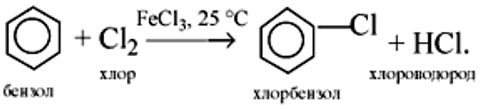
III. РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование -
a) бензола
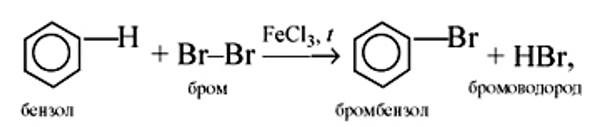
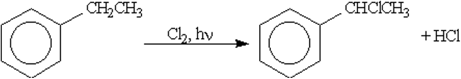
б) гомологов бензола при облучении или нагревании
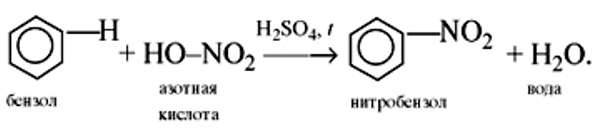
2. Нитрование (с азотной кислотой)