11. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
11.73. Строение электронных оболочек
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно число электронов:
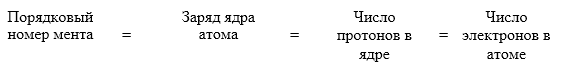
Массовое число равно сумме числа протонов и нейтронов в ядре.
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. (Изотопы содержат одинаковое число протонов, но разное число нейтронов)
Электронная оболочка — это совокупность всех электронов в данном атоме.
Орбиталь — часть атомного пространства, в которой вероятность нахождения электрона наибольшая.
Энергетический уровень — совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Для примера, рассмотрим строение электронной оболочки элемента бора:

Как выглядит электронная оболочка в пространстве:

Строение атома:
-
атом состоит из ядра и электронной оболочки;
-
ядра атомов заряжены положительно, они состоят из протонов p+ и нейтронов no (вместе носят название нуклоны);
-
при образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Орбитали различаются по форме и энергии. Каждая орбиталь обозначается цифрой и лат.буквой. Цифра указывает энергию (энергетический уровень, т. е на сколько далеко орбиталь находится от ядра), а буква ― форму орбитали.
Формы орбиталей:
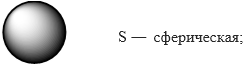
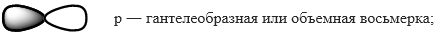
d и f ― более сложной формы.
Одинаковые по форме и энергии орбитали объединяются в подуровни. s подуровень состоит из одной s орбитали, p подуровень — из трех р орбиталей, d подуровень из 5 d орбиталей.
На каждой орбитали может находится не более двух электронов. Поэтому максимальное число электронов на s-подуровне ―2. на р ― 6, на d ― 10.
|
Подуровень |
Количествоорбиталей |
Макс. количество электронов |
||||||
|
s |
s |
1*2=2 |
||||||
|
p |
p |
p |
p |
3*2=6 |
||||
|
d |
d |
d |
d |
d |
d |
5*2=10 |
||
|
f |
f |
f |
f |
f |
f |
f |
f |
7*2=14 |
Электронная конфигурация криптона (последнего элемента 4 периода) записывается следующим образом: 1s22s22p63s23p64s23d104p6.
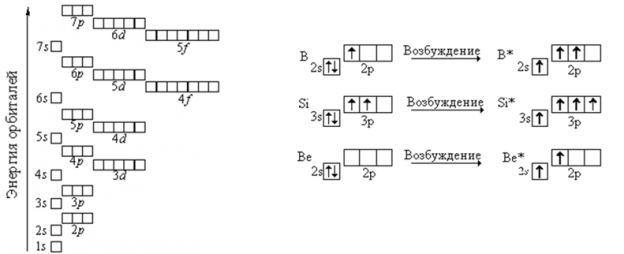
При заполнения электронных оболочек в первую очередь заполняются более низкие, ближайшие к ядру уровни и подуровни (от 1s орбтатали и далее) ― принцип минимума энергии. Порядок заполнения подуровней нужно запомнить!
Суммарная энергия всех электронов атома должна быть минимальной. Если это так, то такое состояние атома называется основным или невозбужденным. Это устойчивое состояние атома. Любое другое состояние атома называется возбужденным.