

11. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
11.321. Типы кристаллических решёток
Кристаллические решетки
Большинство веществ, в зависимости от условий (темература, давление) могут находится в трех агрегатных состояниях. Все твердые вещества можно разделить на аморфные и кристаллические.
КРИСТАЛЛИЧЕСКОЕ ВЕЩЕСТВО: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
АМОРФНОЕ ВЕЩЕСТВО: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.

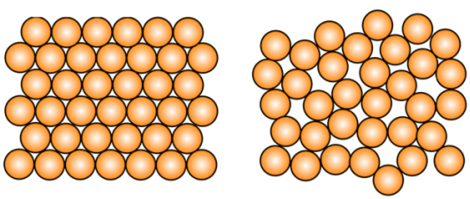
Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
|
Тип кристаллической решетки |
Частицы в узлах решетки |
Характеристики |
Вещества |
тип связи |
|
Молекулярная |
Молекулы |
Не прочный, Низкая Тпл, Летучие |
Благородные газы: Ne, Ar … Галогены: F2, Cl2 Галогеноводороды: HF, HCl … Простые вещества неметаллы: О2, Н2, N2, P(белый) Оксиды и водородные соединения неметаллов: SO2, CO2, NH3, PH3 |
Ковалентная (полярная и неполярная) |
|
Ионная |
Ионы |
Прочная, Высокая Тпл, Нелетучие, Расплавы и растворы проводят эл.ток |
Соли, оксиды и гидроксиды металлов |
Ионная |
|
Металлическая |
Атомы и ионы |
Пластичные Электро- и теплопроводные |
Металлы и сплавы |
Металлическая |
|
Атомная |
Атомы |
Очень прочная, Очень высокие Тпл |
С (алмаз, графит), Si ,Ge, B, SiO2(кремнезем, кварц) Al2O3 CaC2, SiC (карборунд), BN, Fe3C, P черный и красные |
Ковалентная |
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл..






















