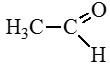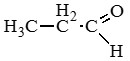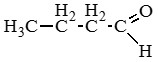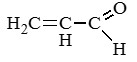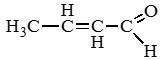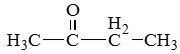39. Органическая химия
 Читать 0 мин.
Читать 0 мин.
39.330. Альдегиды, карбоновые кислоты, сложные эфиры
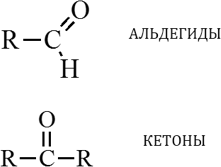
Альдегиды и кетоны.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
Гомологический ряд альдегидов и кетонов:
|
Название |
Формула |
|
Альдегиды |
|
|
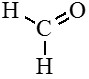
Метаналь (муравьиный альдегид, формальдегид) |
|
|
Этаналь (уксусный альдегид, ацетальдегид) |
|
|
Пропаналь (пропионовый альдегид) |
|
|
Бутаналь (масляный альдегид) |
|
|
Пропеналь (акролеин) |
|
|
Бутен-2-аль (кротоновый альдегид) |
|
|
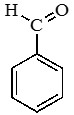
Бензальдегид |
|
|
Кетоны |
|
|
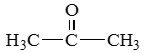
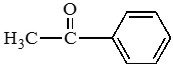
Пропанон (ацетон) |
|
|
Бутанон (метилэтилкетон) |
|
|
Ацетофенон (метилфенилкетон) |
|
Номенклатура и изомерия:
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
Названием альдегида = название алкана + окончание –аль
Алгоритм названия альдегидов:
1. Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
2. Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
3. Назовите соединение по алгоритму для углеводородов.
4. В конце названия допишите суффикс -аль.
Изомерия:
1. Углеродного скелета
2. Межклассовая – кетоны
3. ТОЛЬКО У КЕТОНОВ: положение функциональной группы
Физические свойства:
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8-12 атома «С» - душистые вещества. Альдегиды с 1-3 атомами «С» хорошо растворяются в воду, с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаза и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства альдегидов и кетонов:
Альдегиды – один из наиболее реакционноспособных классов органических соединений, что связанно с наличием в их молекулах высокополяризованной карбонильной группы.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
-
Горение:
2CH3CHO + 5O2 = 4CO2 + 4H2O
-
Присоединение (по двойной связи карбонильной группы).
В ряду
$HCHO \longrightarrow RCHO \longrightarrow RCOR'$ склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):
$HCHO + H_2 \stackrel{Ni, t}{\longrightarrow} CH_3OH$
$CH_3 - CO-CH_3 +H_2 \stackrel{Ni, t}{\longrightarrow} CH_3-CH(OH)-CH_3$
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные.
-
Окисление:
$CH_3CHO + Ag_2O = 2Ag\downarrow + CH_3COOH$ (реакция "серебряного зеркала" - качественная реакция)
$HCHO + 2Cu(OH)_2 = 2H_2O + Cu_2O\downarrow + HCOOH$ (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются.
-
Замещение атомов водорода в углеводородном радикале (замещение происходит в альфа-положение, т. е. замещается атом водорода у 2-го атома углерода):
CH3CHO + Cl2 = CH2Cl-CHO + HCl
Применение важнейших представителей:
Муравьиный альдегид:
1. Полимеры
2. Антисептик
3. Для хранения анатомических препаратов
Уксусный альдегид:
1. Получение этанола
2. Производство зеркал
3. Лекарства
4. Ацетатное волокно
5. Получение уксусной кислоты
6. Получение уксусного ангидрида
7. Получение сложного эфира – этилацетат.
Карбоновые кислоты.
Карбоновые кислоты– это производные УВ, содержащие функциональную карбоксильную группы –СООН.
По основности кислоты делятся на:
1. одноосновные (монокарбоновые)
2. двухосновные (дикарбоновые)
3. трехосновные (трикарбоновые)
Наибольшее значение имеют насыщенные монокарбоновые кислоты.
Номенклатура и изомерия:
|
Формула |
Название кислоты |
Название остатка |
|
|
Систематическое |
Тривиальное |
||
|
HCOOH |
метановая |
меравьиная |
Формиат |
|
CH3COOH |
этановая |
уксусная |
Ацетат |
|
C2H5COOH |
пропановая |
пропионавая |
Пропионат |
|
C3H7COOH |
бутановая |
масляная |
Бутират |
|
C4H9COOH |
пентановая |
валерьяновая |
Валерат |
|
C5H11COOH |
гексановая |
капроновая |
Капрат |
|
C15H31COOH |
гексадекановая |
пальмитиновая |
Пальмитат |
|
C17H35COOH |
октадекановая |
стеариновая |
Стеарат |
|
C6H5COOH |
бензолкарбоновая |
бензойная |
Бензоат |
|
CH2=CHCOOH |
пропеновая |
акриловая |
акрилат |
У насыщенных карбоновых кислот ТОЛЬКО изомерия углеродного скелета.
Физические свойства:
В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот больше температуры кипения соответствующих спиртов.
В водных растворах кислоты образуют линейные димеры.
Химические свойства карбоновых кислот:
Для насыщенных карбоновых кислот характерна высокая реакционная способность. Это определяется главным образом реакциями карбоксильной группы, а также реакциями замещения атомов водорода в альфа-положении.
1. Диссоциация:
R-COOH ↔ RCOO- + H+
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с основными оксидами и основаниями:
2R-COOH + CaO → (R-COO)2Ca + H2O
R-COOH + NaOH → R-COONa + H2O
4. Взаимодействие с солями слабых кислот:
R-COOH + NaHCO → R-COONa + H2O + CO2↑
-
Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + HСl → NaCl + R-COOH
-
В водных растворах гидролизуются:
R-COONa + H2O ↔ R-COOH + NaOH
5. Образование сложных эфиров со спиртами:

Специфические свойства
1. Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
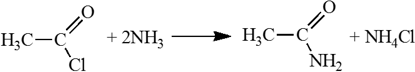
2. Образование амидов
$CH_3COOH + NH_3 \longrightarrow CH_3COOHNH_4 \stackrel{t}{\longrightarrow} CH_3CONH_2 + H_2O$
-
Вместо карбоновых кислот чаще используют их галогенангидриды:
-
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
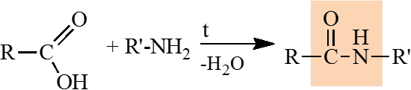
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется альфа-хлорпроизводное карбоновой кислоты):
$CH_3COOH + Cl_2 \stackrel{P\text{красн.}}{=} CH_2Cl-COOH + HCl$
Особенности муравьиной кислоты H-COOH:
1. Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
2. Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
3. Вступает в реакцию с гидроксидом меди(II):
H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O
4.Разлагается при нагревании:
HCOOH t,H2SO4→ CO↑ + H2O
Реакции декарбоксилирования солей карбоновых кислот
(получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
Окисление в атмосфере кислорода:
R-COOH + O2 → CO2 + H2O
Применение важнейших карбоновых кислот:
Муравьиная:
1. Растворители
2. Пестициды
3. Крашение тканей и бумаги
4. Обработка кожи
5. Лекарственные средства
6. Консервирование фруктовых соков, зеленых кормов
7. Дезинфекция емкостей в пищевой промышленности
Уксусная:
1. Растворители
2. Дли пищевых целей
3. Красители
4. Лекарственное средство – аспирин
5. получение производных карбоновых кислот
Эфиры.
Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Изомерия сложных эфиров:
|
Структурная изомерия |
Межклассовая изомерия |
|
|
Углеродной цепи |
Радикалов |
|
|
Пропиловый эфир уксусной кислоты или пропилацетат |
Этиловый эфирпропионовой кислоты или эти пропионат |
Пентановая кислоты |
|
Изопропиловый эфир уксусной кислоты или изопропилацетат |
Метиловый эфир масляной кислоты или метилбутират |
Номенклатура:
Название сложных эфиров образуются из названий соответствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов.
Физические свойства:
Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легкокипящие жидкости с фруктовым запахом. Высшие сложные эфиры – воскообразные вещества (пчелиный воск), все сложные эфиры в воде растворяются плохо.
Химические свойства:
Гидролиз – важнейшее химическое свойство сложных эфиров:
Применение сложных эфиров:
1. Парфюмерия
2. Растворители
3. Пищевая промышленность
4. Лекарственные вещества
5. Пластмассы