39. Органическая химия
 Читать 0 мин.
Читать 0 мин.
39.135. Гомология и гибридизация
Гомология
Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологической разностью этого ряда является метиленовое звено —СН2—.
То есть каждый класс имеет гомологический ряд и все вещества в этом ряду будут является гомологами друг другу.
Гибридизация
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 — Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и трех p—электронов
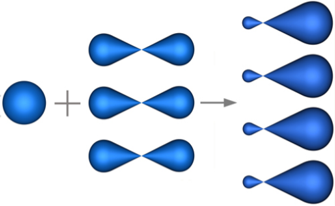
Четыре sp3—гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).
Пространственная конфигурация молекулы, центральный атом которой образован sp3 —гибридными орбиталями —тетраэдр.
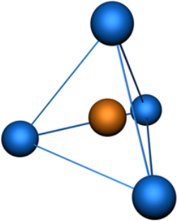
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3—гибридными орбиталями
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота — III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации — sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы — угловая, угол связи составляет 104°27′.
представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp3—гибридизации.
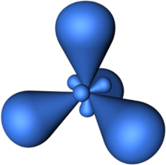
sp2—Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и двух p—электронов
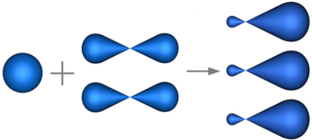
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу

Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2—гибридные орбитали, представлена на рисунке:
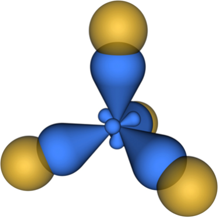
Этот тип гибридизации наблюдается, например в молекуле BCl3.
Модель этой молекулы изображена на рисунке:
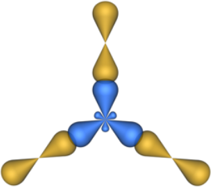
Модель молекулы BCl3
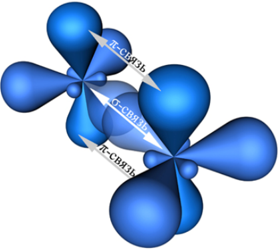
Примеры соединений, в которых наблюдается sp2—гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-. Кроме того, sp2—гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp2—гибридизация) связаны друг с другом двойными химическими связями. При sp2—гибридизации атом углерода образует три σ—связи и одну π—связь с соседними атомами углерода представлена на рисунке:
sp — Гибридизация (линейная)
Одна s— и одна р—орбиталь смешиваются, образуя две равноценные sp—орбитали, расположенные под углом 180°, т.е. на одной оси.
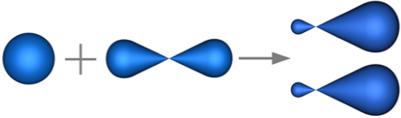
Гибридные sp—орбитали участвуют в образовании двух s—связей. Две р—орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях.
p—Орбитали образуют в соединениях две p—связи.
Для простоты изображения пространственного строения sp—атома обычно рисуют р—орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями.
Углерод в sp—гибридном состоянии присутствует:
-
в соединениях с тройной связью $H{\color{red}C} \equiv {\color{red}C}H, R{\color{red}C} \equiv {\color{red}C} R, R{\color{red}C}\equiv {\color{red}N} $
в соединениях типа R2C=C=CR2