

11. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
11.203. Типы химической связи
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
Рассмотри образование ковалентной неполярной связи, на примере водорода:
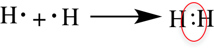
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
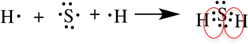
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из отдает свои электроны и он заряжется положительно. Элемент, который принимает электроны заряжается отрицательно.
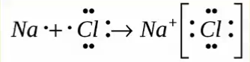
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).
|
Тип связи |
Примеры |
|
Ковалентная неполярная |
Cl2, O2, Br2, I2, N2 и др. |
|
Ковалентная полярная |
HCl, H2S, HBr, H2O, SO2, SO3 и др. |
|
Ионная |
NaCl, KCl, CaBr2, Na2O и др. |
|
Металлическая |
Na, Ca, Zn, Al и др. |
|
Водородная |
Между молекулами:
|






















