

11. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
11.545. Химическое равновесие
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлениях:
$A + B \underset{\text{Обратная реакция}}{\stackrel{\text{Прямая реакция}}{\rightleftharpoons}} C + D$
Когда скорости прямой и обратной реакции станут одинаковыми, наступает химическое равновесие.
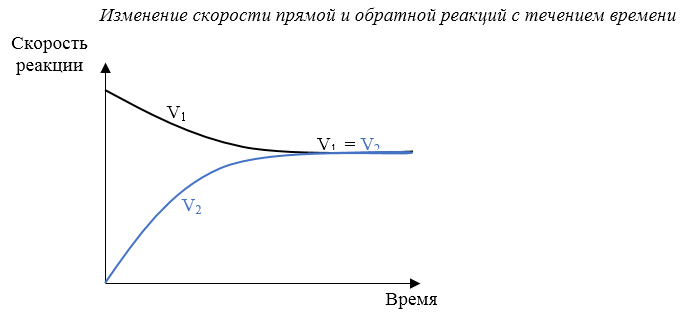
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Факторы, влияющие на сдвиг химического равновесия:
- Концентрации любого из веществ.
- Температура.
- Давление.
Направление смещения равновесия определяется принципом Ле-Шателье:
Если на систему, находящуюся в равновесии оказать какое-либо воздействие (изменить t, C, P), то равновесие смещается в сторону реакции, которая противодействует этому воздействию.
Влияние концентрации реагирующих веществ:
Если в равновесную систему вводится какое-либо из участвующих веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-то вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
${\color{red} {N_2} } + {\color{cyan} {3H_2}} = {\color{green} {2NH_3}}$
Для смещения равновесия вправо необходимо в равновесную смесь вводить азот и водород и выводить из равновесной системы аммиак.
Влияние температуры:
Прямая и обратная реакции имеют противоположные тепловые эффекты.
N2 + 3H2 = 2NH3 + 92кДж
2NH3 = N2 + 3H2 – 92кДж
Повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления:
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давление.
Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
N2 + 3H2 = 2NH3
Повышая давление в системе, мы будем смещать реакцию в сторону образования аммиака.






















