

11. Теоретические основы в химии
 Читать 0 мин.
Читать 0 мин.
11.406. Электролитическая диссоциация и реакции ионного обмена
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов.
И все вещества по способности проводить электрический ток можно разделить на 2 группы: электролиты и неэлектролиты.
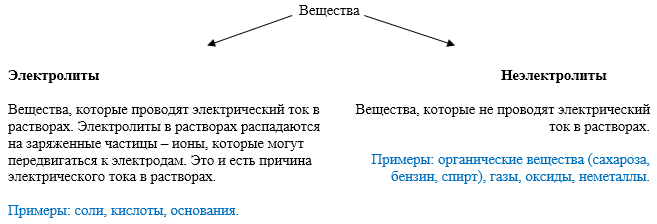
В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые:
|
Сила электролита |
Класс соединений |
Примеры |
|
Сильные (степень диссоциации от 30% до 100%) |
1. Растворимые соли 2. Щелочи 3. Сильные кислоты |
NaCl, KCl, CuSO4, Сa(OH)2, HCl, HBr, HI, H2SO4, HNO3, HClO4, HclO3, H2CrO4, HMnO4, CH3COONa |
|
Средней силы (Степень диссоциации от 2% до 30 % |
Некоторые кислоты |
H3PO4, H2SO3, HNO2 |
|
Слабые (степень диссоциации меньше 2%) |
1. Нерастворимые соли 2. Нерастворимые основания 3. Слабые кислоты 4. Органические кислоты |
H2SiO3, HCN, CH3COOH, |
Степень диссоциации – $a = \displaystyle \frac{n}{N}$, где n-число распавшихся (диссоциированных) молекул, N-общее число молекул.
При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
В случае сильных электролитов распад на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, этому препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
Диссоциация слабых электролитов ― обратимый процесс. Это значит, что в растворе присутствуют как ионы, так и недиссоциированные молекулы.
Все электролиты можно разделить на 3 группы: кислоты, основания и соли.
Кислоты ― это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют.
Многоосновные кислоты диссоциируют ступенчато.
H3PO4 ⇄ H+ + H2PO-4, α = 23,5%
H2PO-4 ⇄ H+ + HPO2-4, α = 3 ∙ 10-4 %
HPO2-4 ⇄ H+ + PO3-4, α = 2 ∙ 10-9 %
Основания ― это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют. Диссоциация нерастворимых оснований не происходит, нет ионов в растворе.
К сильным основаниям относят все щелочи, т. е. все растворимые основания, кроме гидроксида аммония.
KOH = K+ + OH-, Ca(OH)2 = Ca2+ + 2OH-.
Средние соли ― это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+, и любые анионы, кроме ОН-.
Все растворимые соли ― сильные электролиты.
Cu(NO3)2 = Cu2+ + 2NO-3;
Al2(SO4)3 + 2Al3+ + 3SO2-4;
Na(CH3COO) = Na+ + CH3COO-.
Реакции между электролитами ― это реакции между ионами, которые образовались при их диссоциации, поэтому их записывают и в молекулярном, и в ионном виде. Протекают всегда в сторону наиболее полного связывания ионов.
|
Молекулярное |
Полное ионное |
Краткое ионное |
|
H2SO4+ 2KOH=K2SO4+2H2O |
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O |
H+ + OH- = H2O |
|
K2CO3+ 2HNO3=2KNO3+ CO2+H2O |
2K++ CO2-3 + 2H+ +2NO3- = 2K+ + 2NO3- + CO2 + H2O |
2H+ + CO2-3 = CO2 ↑+ H2O |
| $Al_2(SO_4)_3 + 3BaCl_2 = 3BaSO_4 \downarrow + 2AlCl_3$ |
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 3BaSO4 + 2Al3+ + 6Cl- |
SO42- + Ba2+ = BaSO4 ↓ |
Ионные реакции протекают практически необратимо, если образуются:
- малорастворимые вещества (они выпадают в осадок),
- легколетучие вещества (они выделяются в виде газов)
- слабые электролиты (в том числе и вода).
В ионных уравнениях:
- электролиты записывают в ионном виде;
- неэлектролиты и слабые электролиты ― в молекулярном виде;
- в ионном уравнении сумма зарядов ионов в левой части и правой части равны.






















